
De momento aprendimos que los átomos se pueden considerar bolas de distinta masa y tamaño, entre otras cualidades, que se podían unir entre sí en proporciones constantes y enteras para formar moléculas. Por ejemplo el agua, H2O, significa que tendría 2 bolas de Hidrógeno y una bola de Oxígeno para formar una molécula de agua, independientemente de la reacción química de la que se haya formado ese agua... De hecho los modelos de moléculas siguen representándose con bolitas.

Aquí teneis un ejemplo de molécula más compleja: la cafeína, compuesta por átomos de Carbono, Hidrógeno y Oxígeno, representados con bolas de distinto tamaño:
Pero seguiamos sin saber si los átomos eran bolas macizas o no, y cómo explicar las propiedades eléctricas de la materia...
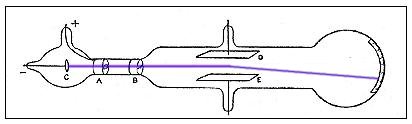
En 1897 Joseph John Thompson realiza una serie de experimentos y descubre el electrón usando tubos de rayos catódicos. En tubos de gases a baja presión en los que se establece una diferencia de potencial superior a 10.000 voltios, se comprobó que aparecían partículas con carga eléctrica negativa a las que se llamó electrones, y demostró que habían sido arrancados de los átomos (los cuales eran neutros). Tal descubrimiento modificó el modelo atómico de Dalton, que lo consideraba indivisible. Thompson supuso el átomo como una esfera homogénea e indivisible cargada positivamente en la que se encuentran incrustados los electrones, como si fuera un pastel de pasas donde las cargas positivas formaban la masa del pastel y las cargas negativas eran las pasas.

Posteriormente otro físico inglés, Ernest Rutherford, realizó una serie de experimentos para demostrar que los átomos están huecos básicamente. Hizo incidir sobre una lámina finísima de oro un delgado haz de partículas cargadas positivamente de masa mucho mayor que el electrón y dotadas de energía cinética alta. En el choque observó distintos comportamientos:
la mayoría atravesaban la lámina sin desviarse, algunas se desviaban y muy pocas retrocedían; por tanto, implica que los átomos estaban casi vacíos, pues la mayoría de las partículas las atravesaban; y que hay una zona cargada positivamente, ya que algunas partículas retrocedían o se desviaban.

Esta zona debe estar muy concentrada ya que es mayor el número de desviaciones que de choques. Esto le condujo a proponer en 1911 un nuevo modelo atómico en el que se afirmaba que los átomos estaban constituidos por 2 zonas bien diferenciadas:
Una de carga positiva con el 99,9% de la masa muy concentrada y por tanto de gran densidad a la que llamó núcleo.
Otra rodeando al núcleo a la que llamó corteza donde estaban los electrones con carga negativa girando alrededor del núcleo.
 Para que os hagais una idea del hueco que hay entre núcleo y primeros electrones de la corteza, imaginad que el núcleo es una pelota de tenis en el centro de un campo de fútbol, pues el primer electrón estaría en la puerta exterior del campo de fútbol... Sólo hay que hacer unas sencillas reglas de 3 para averiguarlo...
Para que os hagais una idea del hueco que hay entre núcleo y primeros electrones de la corteza, imaginad que el núcleo es una pelota de tenis en el centro de un campo de fútbol, pues el primer electrón estaría en la puerta exterior del campo de fútbol... Sólo hay que hacer unas sencillas reglas de 3 para averiguarlo...Ahora sí se podían explicar las propiedades eléctricas de la materia, aunque no se sabía determinar la distancia y la forma en que giraban los electrones alrededor del núcleo. Lo veremos en una próxima entrada...
.jpg)




No hay comentarios:
Publicar un comentario